
以细胞及细胞成分为基础的细胞基生物材料,因在肿瘤治疗、再生医学和药物研发领域的广泛应用而备受关注。鉴于巨噬细胞具有肿瘤趋向、吞噬杀伤、抗原递呈和分泌细胞因子调节免疫微环境的能力,基于活巨噬细胞的细胞基材料逐渐兴起。然而,免疫抑制的肿瘤微环境极易将过继转输的巨噬细胞由促炎抗肿瘤的M1表型转变为抑炎促肿瘤的M2表型,严重削弱抗肿瘤效果。因此,开发一种具有理想表型和抗肿瘤免疫活性的治疗性巨噬细胞具有重要意义。
2024年9月23日,山东大学张娜教授、刘永军教授团队在Nature Communications期刊发表题为“Glypican-3-targeted macrophages delivering drug-loaded exosomes offer efficient cytotherapy in mouse models of solid tumours”的研究论文,山东大学2023级博士研究生刘金虎为论文第一作者,张娜教授、刘永军教授为论文共同通讯作者。

张娜,山东大学药学院教授,国家(山东)重大新药创制平台临床前药代动力学平台主任,教育部新世纪优秀人才,山东省泰山产业领军人才。主要从事靶向纳米给药系统用于药物、基因和诊断因子递送的研究。先后承担国家级、省部级课题 23 项。在 Nat Commun、ACS Nano、J Control Release 等高水平期刊发表研究论文 160 余篇,授权专利 27项,主编国家级规划教材《生物药剂学与药物动力学》。2014-2023年连续10年入选 Elsevier 中国高被引学者,2020-2023 年连续4年荣登药学领域全球 2%顶尖科学家榜。现任中国药学会纳米药物专业委员会委员,中国颗粒学会药物制剂与粒子设计专业委员会委员等。

刘永军,山东大学药学院教授,泰山学者青年专家,山东省优秀青年基金获得者,齐鲁青年学者。长期从事智能纳米药物递送系统用于药物靶向递送、显影诊断、化学免疫联合治疗相关研究。先后承担国家级、省部级课题8项。近五年,以通讯作者身份在 Nat Commun、Adv Funct Mater、J Control Release 等高水平期刊发表研究论文 22 篇,授权专利9项。现任中国抗癌协会纳米肿瘤学专业委员会青年委员等。

刘金虎,山东大学药学院 2023 级博士研究生,主要从事巨噬细胞制剂用于肿瘤治疗的相关研究。截至目前,以第一或共一作者身份在 Nat Commun、ACS Nano、Acta Pharm SinB等期刊发表学术论文5篇,授权专利3项。曾获得国家奖学金,被授予山东省优秀学生、山东省优秀学生干部、山东省优秀毕业生等荣誉称号。

DOI:10.1038/s41467-024-52500-5
该研究设计了表面锚定Glypican-3靶向肽,内部携带肿瘤治疗药物的纳米编辑巨噬细胞制剂(RILO@MG)。锚定的靶向肽促进巨噬细胞制剂的肿瘤细胞识别功能,增强了高表达Glypican-3肿瘤细胞的特异性靶向和吞噬作用。内部携带共载TLR7/TLR8激动剂R848和吲哚胺2,3-双加氧酶1抑制剂INCB024360的纳米药物,该纳米药物包裹富含C16神经酰胺的外膜囊泡(RILO)。其中,外膜囊泡的包裹促使纳米药物通过小窝蛋白介导的内吞作用进入巨噬细胞制剂内部,C16神经酰胺能够通过诱导膜内陷和外泌体产生,促使巨噬细胞制剂携带的RILO通过外泌体形式释放。研究表明,RILO@MG在高表达Glypican-3的荷瘤小鼠模型中展现出优异的抗肿瘤效果。总的来说,该工作为研发治疗实体瘤的细胞制剂奠定了关键理论基础,有望丰富和发展临床现有细胞治疗手段。
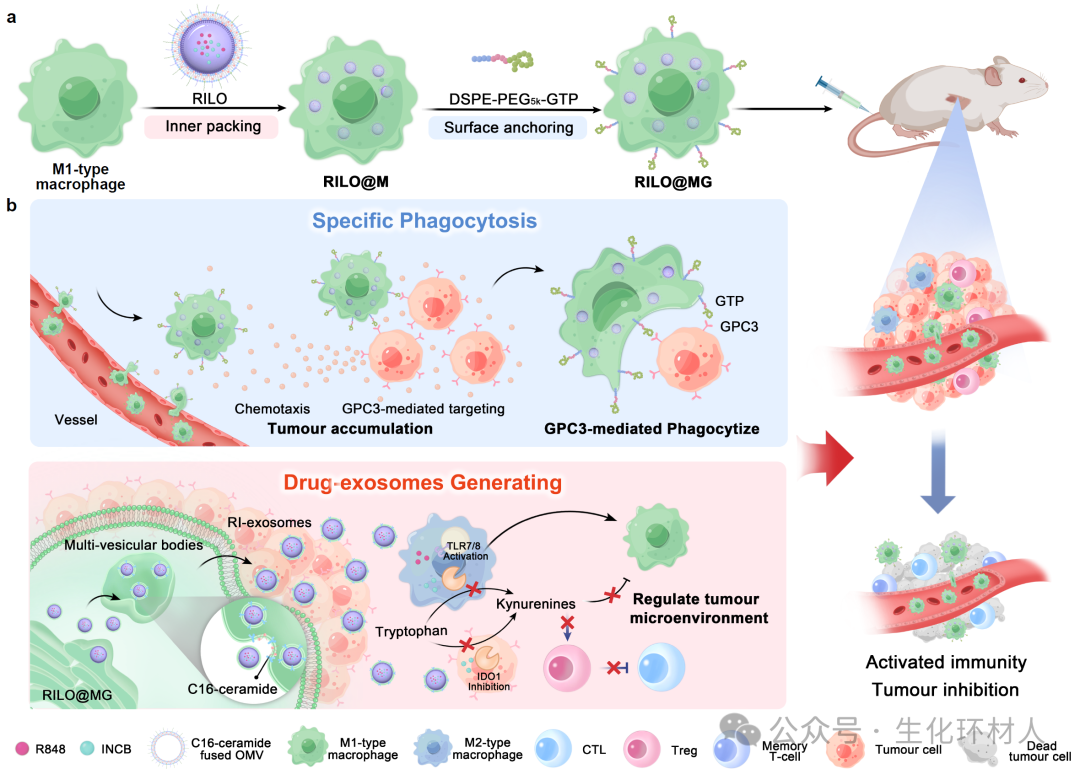
图1 纳米编辑巨噬细胞制剂促进特异性吞噬肿瘤细胞并产生药物外泌体的示意图
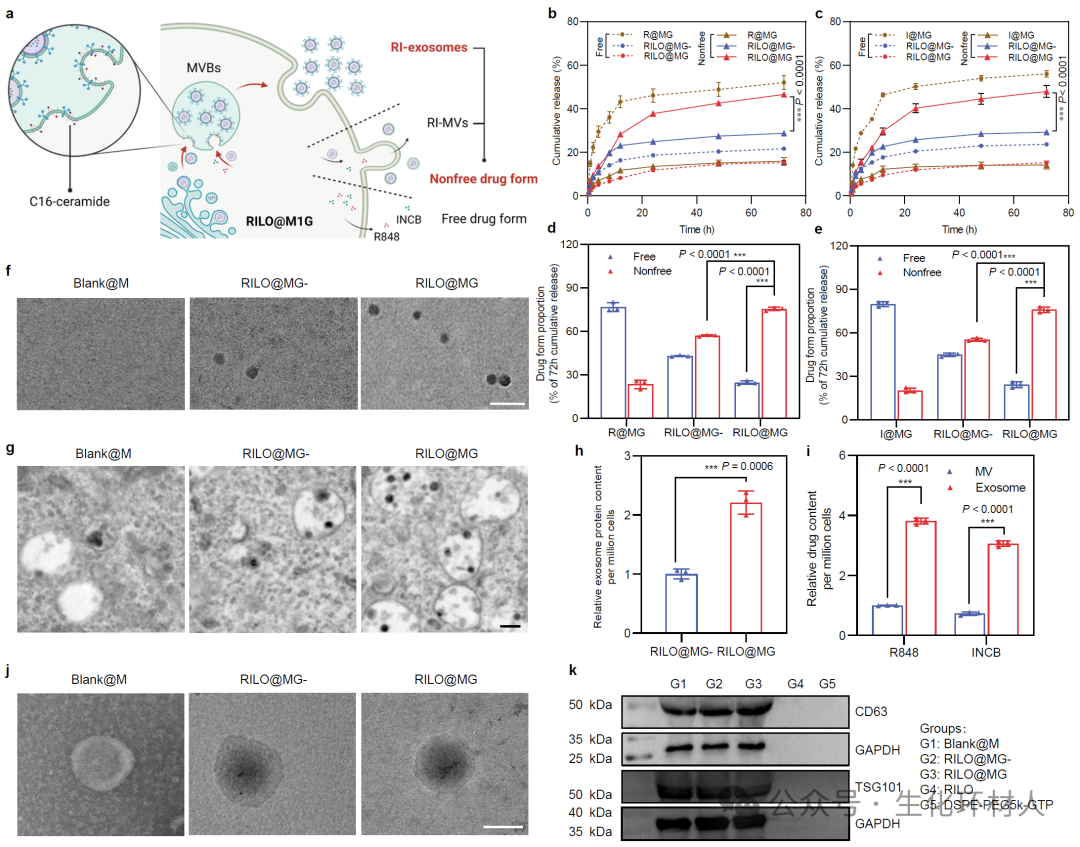
图2 巨噬细胞制剂装载的纳米药物能够保持稳定的纳米结构,并以外泌体形式释放
经静脉注射后,RILO@MG凭借巨噬细胞固有肿瘤趋向性和Glypican-3介导的肿瘤靶向作用,主动靶向并蓄积于肿瘤部位。在肿瘤部位,具有圆锥形结构的C16神经酰胺能够自发诱导膜中磷脂双分子层负向曲率,引起膜内陷,促进腔内囊泡形成,进而促使RILO@MG以外泌体形式释放纳米药物。通过RILO@MG药物释放曲线、胞内微观形态及释放液分离纯化等实验,进一步证实RILO@MG通过生成药物外泌体(RI-exosome)实现胞内纳米药物的释放。
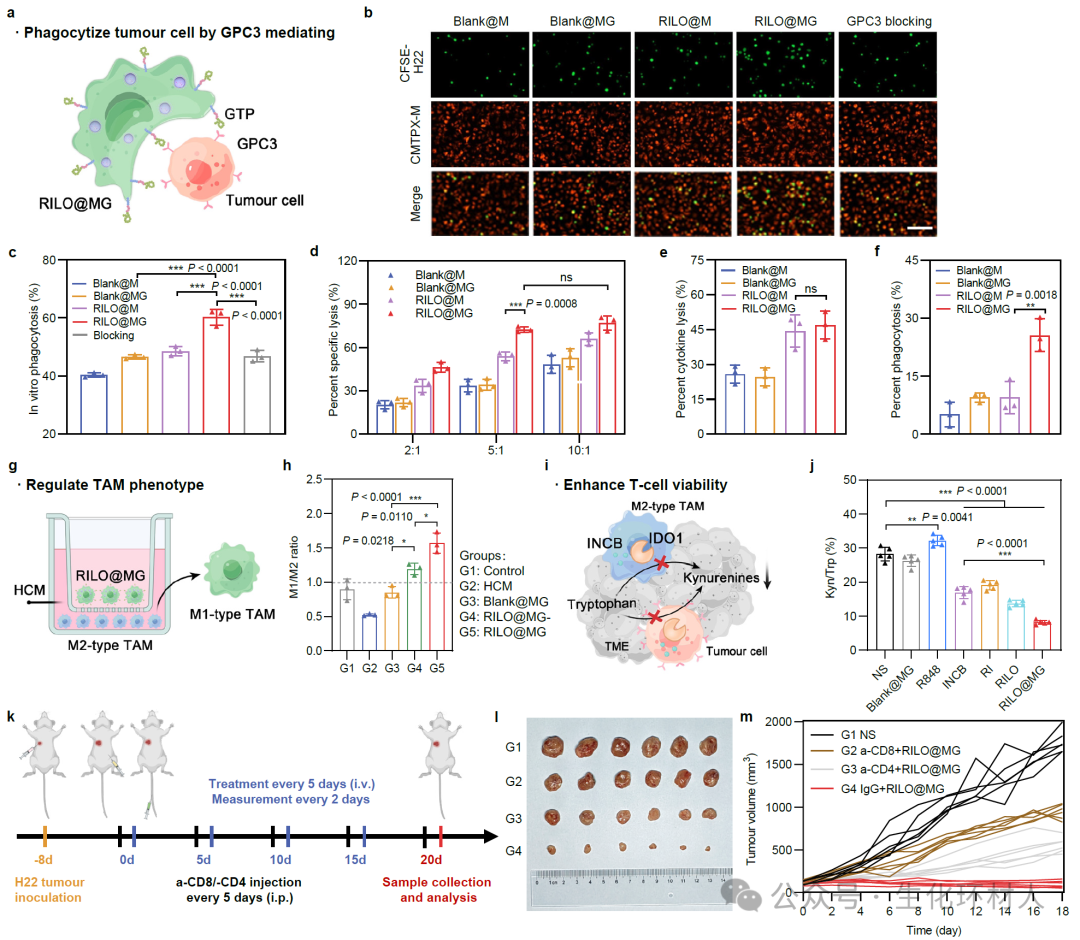
图3 巨噬细胞制剂通过特异性吞噬肿瘤细胞、调节肿瘤相关巨噬细胞表型和增强T细胞活力的机制发挥抗肿瘤免疫治疗作用
进一步地,RILO@MG通过表面锚定的Glypican-3靶向肽,实现肿瘤细胞的特异性识别、粘附、吞噬和杀伤;RILO@MG释放的RI-exosome含有R848和INCB024360,能够强化过继转输的巨噬细胞和肿瘤相关巨噬细胞维持抗肿瘤M1表型;同时,INCB024360能够降低犬尿氨酸与色氨酸百分比,增强T细胞活力。研究结果表明,RILO@MG在H22荷瘤小鼠模型、原位肝癌小鼠模型、再挑战肿瘤模型中均显示了良好的抗肿瘤效果。该研究结果凸显了纳米编辑巨噬细胞制剂在促进抗肿瘤免疫反应并提高实体瘤疗效方面的关键作用,有望减少患者治疗成本与时间,提高患者可及性,具有广阔的临床应用前景。























 上一篇
上一篇










