蛋白结构和功能相互对应且处于动态变化,然而蛋白结构大多在静态平衡条件下检测而得,并不能完全揭示蛋白的动力学性质。为了进一步研究蛋白结构动力学变化与功能的对应关系,北京大学化学与分子工程学院郭雪峰教授课题组和澳大利亚阿德莱德大学喻敬贤博士、Andrew D. Abell教授课题组合作,设计了具有光响应结构变化的单分子多肽纳米器件(图1),并利用环肽分子随光照变化展现的不同二级结构特征,揭示了单分子环肽的光响应动力学特点,为阐释单分子水平下蛋白结构转变与功能的对应关系提供了思路,并向多模生物纳米器件的设计与实现迈出了重要一步。
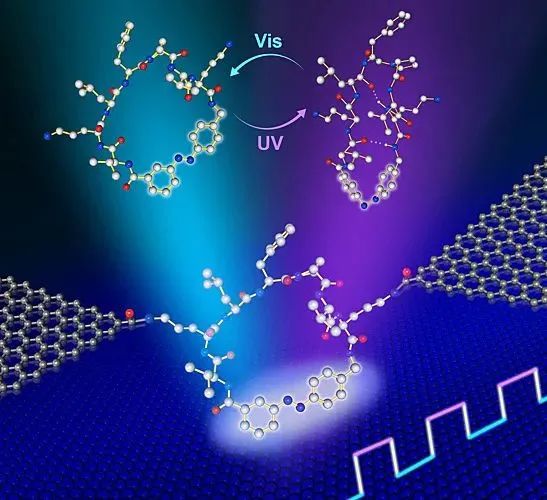
图1. 器件结构示意图
结果表明,环肽分子在紫外光照条件下,电导值明显优于可见光时的电导值(图2),这与理论模拟的透射谱相符合。
该研究还进一步分析了环肽不同二级结构下的导电水平,在暗态和可见光条件下,分子电导呈现明显的三态分布(图3左),此时偶氮苯基团为反式结构,环肽分子表现为无序二级结构,分子动力学模拟表明,影响分子电导的主要因素是偶氮苯基团与石墨烯电极间的二面角,随着该二面角的变化,分子电导相应呈现规律性振荡且具有三个明显的导电态,其分布占比与实验结果基本吻合。
这种结构转变的动力学行为模式可以扩展到对无序蛋白结构和功能的认识,即依靠瞬时但规律性的结构变化实现特定的生物学功能,如细胞内的信号传递。当光照切换为紫外光时,分子电导迅速上升且同样具有明显的三态分布特点(图3右),此时偶氮苯处于顺式结构,环肽分子上下两部分间距缩短,分子内形成两个氢键,此时影响分子电导的可能因素包括偶氮苯基团与石墨烯电极形成的二面角和分子内两个氢键距离的变化,通过控制变量,他们发现其中一个氢键键长的变化是此时分子电导波动的决定因素,即随着该氢键键长的增加,分子电导值呈现逐渐减弱的趋势,结合动力学模拟的键长分布,可以明显地发现强、中、弱氢键对应了实验结果中分子导电的三个状态。这种由氢键距离引起的结构动力学变化,为揭示氢键维持蛋白二级结构的重要性提供了关键证据。
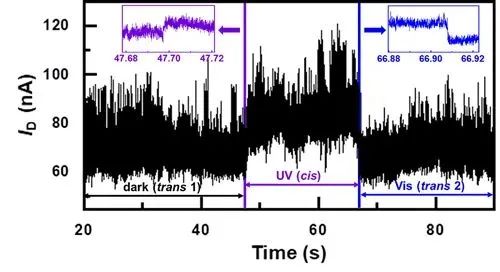
图2. 环肽分子光响应实时电学检测
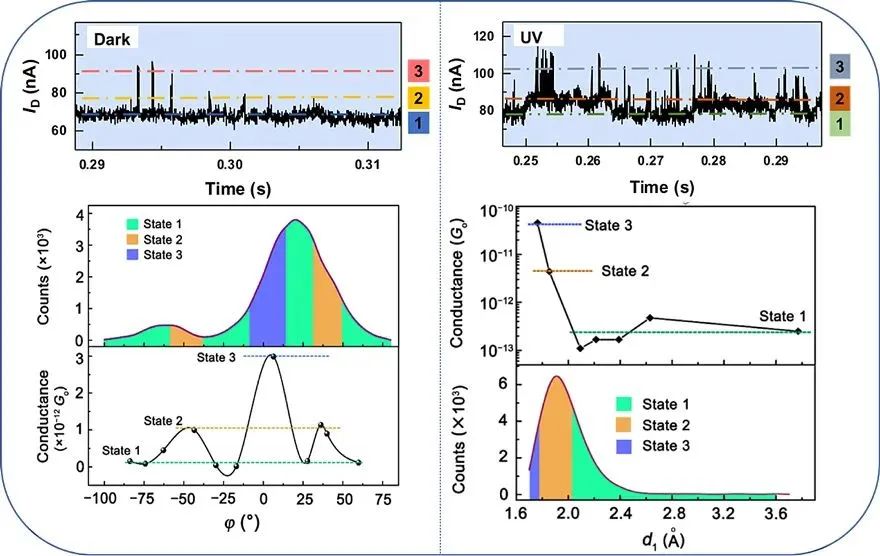
该工作不仅展示了单分子环肽的光致异构与导电水平的对应关系,更揭示了不同二级结构内影响分子电导的动力学因素,这种调控多肽电导水平的策略为设计功能化多模式生物纳米电学器件提供了可能性。
该工作成果近期发表在Angewandte Chemie International Edition,文章的共同第一作者分别是北京大学郭雪峰课题组的博士生陈新佳妮、澳大利亚阿德莱德大学Andrew D. Abell课题组的博士生Yuan Qi Yeoh和山西长治医学院的贺艳斌博士,通讯作者为郭雪峰教授、Andrew D. Abell教授和喻敬贤博士。























 上一篇
上一篇










