中国科学院南海海洋研究所研究员鞠建华课题组揭示了聚醚类抗生素K-41A的生物合成途径,并阐明了其结构骨架中6个位置的甲基化修饰机制,发现不同的甲基化和糖基化修饰状态可改变其抗菌和抗HIV病毒活性。相关研究近日发表于《有机化学通讯》。
聚醚类抗生素是一类具有多个不对称中心,并含有两个或两个以上四氢呋喃环和四氢吡喃环的聚酮羧酸类天然产物。目前已报道并阐释了生物合成途径的聚醚类抗生素包括莫能霉素、拉沙里菌素、南昌霉素、尼日利亚菌素和盐霉素等,其展现出多样的生物活性,如抗菌、抗寄生虫、抗病毒和抗肿瘤等。其中,莫能霉素、拉沙里菌素、盐霉素等作为兽药广泛应用于畜牧业中。
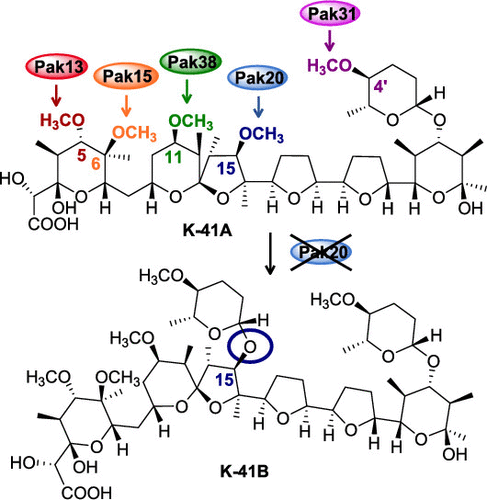
鞠建华表示,该研究中的K-41A是由分离自南海沉积物样本的海洋放线菌Streptomyces sp. SCSIO 01680所生产的,通过全基因组测序和基因敲除实验确定其由I型PKS基因簇编码。在前人的研究基础上结合生物信息学分析,研究人员合理推测了K-41A的生物合成途径,其起始单元为乙酰CoA,衍生单元为丙二酰CoA和甲基丙二酰CoA,通过14步脱羧缩合生成聚酮骨架,后经过一系列复杂的后修饰过程,包括环氧化、环氧开环级联成醚、羟化、甲基化和糖基化等,最终形成聚醚类抗生素K-41A。
相比于其它聚醚类抗生素,K-41A具有较多的O-甲基化修饰,推测其可能影响化合物的理化性质和生物活性,于是研究人员对基因簇中所含有的5个甲基转移酶基因分别进行了敲除,并从各甲基转移酶突变株中分离获得了相应的脱甲基和/或脱糖基衍生物,共9个。由于该类化合物无紫外吸收,所以采用活性导向的方法进行追踪,最后通过制备型TLC分离制备获得目标化合物。在结构解析确定各衍生物的脱甲基位置的同时,各甲基转移酶的区域选择性修饰位置也得到了鉴定,5个甲基转移酶Pak13,Pak15,Pak20,Pak31和Pak38分别负责C5,C6,C15,C4’和C11的O-甲基化修饰。
有趣的是,研究人员并没有从突变株pak20和pak31中分离获得直接的脱甲基衍生物,却分别获得了双糖化修饰的K-41B,K-41Bm和酮糖取代或脱糖基的K-41A衍生物,表明糖基转移酶Pak16具有一定的杂泛性。通过LC-MS分析野生型菌株01680的发酵产物发现,野生型中也可提取到K-41B的离子流但相对于K-41A其强度非常低。推测甲基转移酶Pak20和糖基转移酶Pak16对底物具有一定的竞争性,在野生型菌株中甲基转移酶Pak20占据主导地位,而敲除pak20后K-41B才得以大量积累。
在9个脱甲基和/或脱糖基衍生物中,化合物K-41Bm (7)和K-41Gm (10)具有额外的C29-O-甲基化修饰,在野生型菌株01680的分离过程中也获得了K-41A的C29甲基醚同系物K-41Am,但却未在基因簇中找到相应的甲基转移酶基因。通过文件检索发现,该位的甲基化修饰可通过在酸性甲醇溶液中反应实现。于是研究人员对K-41B (6), K-41Bm (7)和K-41G (9), K-41Gm (10)两组化合物进行了化学转化实验,结果显示K-41B和K-41G确实可在酸性甲醇中转化为相应的C29甲基醚同系物K-41Bm和K-41Gm。研究人员还发现K-41Bm和K-41Gm在酸性甲醇中也可发生C29位脱甲基化反应相应地变成K-41B和K-41G。
对于上述可逆的转化过程,研究人员推测了醇解-甲基化和水解-脱甲基化可能的反应机制。鉴于C29位甲基化/脱甲基化可通过人为干预发生,研究人员又分析了菌株01680发酵液的LC-MS谱图,通过离子流的提取最终确证了K-41A为真正的天然产物,而C29甲基醚同系物则是在萃取分离过程中发生甲基化修饰而产生的。
据了解,基于活性检测结果,发现C11位脱甲基后使其抗菌和抗HIV活性均略有降低,而C5,C6,C4’位的脱甲基化或C27位的脱糖基化则导致其对不同抑制对象表现出不同程度的活性降低甚至失去活性。表明不同的甲基化和糖基化修饰状态对K-41A的生物活性具有重要的影响,这为后续的结构改造、活性优化奠定了研究基础。
相关论文信息:https://doi.org/10.1021/acs.orglett.0c01347




















 上一篇
上一篇









